Vorbereitungen
Die vorliegende Unterrichtseinheit „Bei welchem Wasser brauche ich mehr Seife?“ ist die anspruchsvollste dieser Sequenz. Sie stellt hohe Anforderungen sowohl an das Vorstellungs- und Denkvermögen der SchülerInnen als auch an die didaktische Reduktion durch den Lehrer. Auch der Vorbereitungsaufwand ist höher, v.a. die Versuche müssen genau vorbereitet und vorher selber auch probiert werden. In Gegenden mit sehr hartem Wasser kann evtl. das Leitungswasser für die Versuche verwendet werden. In Gegenden mit weichem bzw. mittelhartem Wasser sollte der Lehrer Kalkwasser vorbereiten, um gut sichtbare Versuchsergebnisse zu erhalten.
Die Unterrichtseinheit beschäftigt sich mit dem unterschiedlichen Kalkgehalt verschiedener Wasserarten und dessen Auswirkung auf die Dosierung von Waschmitteln. Ausgehend von der fühlbaren Qualität zweier T-Shirts, von denen eines mit destilliertem Wasser gewaschen wurde und eines mit „hartem“ Wasser, allerdings mit der gleichen Waschmittelmenge, sollen die SchülerInnen unterschiedliche Wasserarten vermuten. Die Flecken in den T-Shirts sollten auch unterschiedlich stark zu sehen sein. Hier kann evtl. auch bereits das Vorwissen der SchülerInnen über ihr Leitungswasser aufgegriffen werden. In verschiedenen Stationen untersuchen die SchülerInnen nun verschiedene Wasserarten. Eine Beschränkung auf die zwei Arten destilliertes Wasser und Kalkwasser ist sinnvoll, da hier die Unterschiede und deren Auswirkungen auf die Waschwirkung des Wassers am deutlichsten werden. Die im Unterrichtsverlauf vermerkten Erkenntnisse sollten an dieser Stelle in einem intensiven Lehrer-SchülerInnen-Gespräch thematisiert werden.
Aufgrund der verringerten Waschwirkung in hartem Wasser enthalten heutige Waschmittel bereits eine Reihe von Zusatzstoffen, um dies zu vermeiden. An dieser Stelle ist es sinnvoll, Waschmittelpackungen und deren Dosierungsanleitungen zu betrachten, da dort auch bereits auf die unterschiedlichen Härtegrade eingegangen wird. Die Kinder erhalten als Hausaufgabe Teststäbchen als Hilfen zur Bestimmung der Wasserhärte ihres eigenen Leitungswassers. Teststäbchen zur Feststellung der Wasserhärte kann man in Apotheken oder evtl. auch im Elektrogroßhandel kaufen.
Material
- Materialien für die einzelnen Versuche (siehe Versuchsanleitungen)
- Verschmutzte T-Shirts
- Leinenstreifen für Versuch 5
- Kalkwasser
Vorbereitung der verschmutzten T-Shirts
- 2 weiße T-Shirts mit Flecken wie in UE 1
- Ein T-Shirt genauso vorbehandeln wie die Leinenstreifen zu Versuch 3 (siehe unten). Das T-Shirt darf auf keinen Fall ausgespült werden. Damit der Effekt deutlicher wird, darf auch kein Waschmittel zugegeben werden.
- Das andere T-Shirt in weichem Wasser mit etwas Waschmittel waschen und gut ausspülen.
Im Rahmen der Unterrichtseinheit gehen die SchülerInnen aber dann davon aus, dass beide mit der gleichen Waschmittelmenge gewaschen wurden. Der Lehrer muss hier zugunsten der Versuchsdurchführung etwas schwindeln.
Vorbereitung der Leinenstreifen für Versuch 5
- Leinenstücke einige Zeit in stark kalkhaltigem Wasser einweichen
- Leinenstücke ohne ausspülen trocknen
- Um den Effekt der Wasserhärte zu verdeutlichen, sollte diese Prozedur noch mindestens ein weiteres Mal mit den Leinenstücken wiederholt werden.
Herstellung von Kalkwasser
ACHTUNG! Kalkwasser sollte nicht ohne Aufsicht in die Hände kleiner Kinder kommen. Wenn etwas davon in die Augen gerät, unbedingt sofort gründlich mit kaltem Wasser ausspülen. Beim Umgang mit Kalkwasser sollten die Kinder unbedingt eine Schutzbrille aufhaben und vorher vom Lehrer belehrt werden. Auf keinen Fall sollten die Kinder das Kalkwasser selber herstellen.
Material
- Schutzbrille, Gummihandschuhe
- Calciumhydroxid Ca(OH)2 (erhältlich in der Apotheke oder im Chemiefachhandel, auch unter dem Namen Löschkalk bekannt)
- Alternative: Bariumhydroxid Ba(OH)2 (Vorsicht: beides ist stark ätzend!)
- heißes Wasser
- großer Filter aus Plastik oder Porzellan
- passendes Filterpapier
- beschriftete Schraubgläser zur Aufbewahrung
Herstellung
- Mit Schutzbrille und Gummihandschuhen arbeiten
- Calciumhydroxid in heißem Wasser auflösen (pro Liter ca. 5 Teelöffel, bei geringerer Konzentration auch weniger)
- Lösung flitrieren und das – nun klare – Kalkwasser in den Schraubgläsern aufbewahren
Anmerkungen
- In Gegenden mit sehr kalkhaltigem Leitungswasser kann evtl. auch dies zu den Versuchen verwendet werden. Die Versuchsergebnisse sind jedoch mit Kalkwasser deutlicher. Man muss es nicht in hoher Konzentration herstellen. Oft reicht schon eine geringe Zugabe von Calciumhydroxid.
- Als Alternative zu Calciumhydroxid kann auch die doppelte Menge an Blitzzement oder -mörtel verwendet werden (pro Liter ca. 10 Teelöffel).
- Kalkwasser ist nur begrenzt haltbar. Lässt man Kalkwasser längere Zeit in einem unverschlossenen Gefäß stehen, so wird die Lösung unbrauchbar, da sie Kohlenstoffdioxid aus der Atmosphäre absorbiert, so dass sich unter Verbrauch von gelöstem Calciumhydroxid ein unlöslicher Niederschlag von Calciumcarbonat bildet.
- Wird zuviel CO2 eingeleitet, sieht man keine Trübung (Entstehung des löslichen Hydrogencarbonats). Dann muss entsprechend Kalkwasser nachgeschüttet werden.
- Um die Kalkhaltigkeit zu untersuchen, können Sie auch in der Apotheke Teststäbchen zur Bestimmung der Wasserhärte besorgen (siehe Materialteil, Arbeitsaufträge für Gruppenarbeit, Versuch 4).
Nachweis von Kohlendioxid mit Kalkwasser
Im Kalkwasser befinden sich Calciumionen. Leitet man nun das Gas Kohlendioxid in das Kalkwasser, so entsteht aus den Calciumionen und dem Kohlendioxid Calciumcarbonat, der Kalk. Kalk ist eine in Wasser schwer lösliche Verbindung und flockt deshalb als weißer Niederschlag aus.
Das Kohlendioxid, das nachgewiesen werden soll, kann man auf verschiedene Arten erzeugen:
- Durch einen Strohhalm einige Zeit ins Kalkwasser pusten: Auch unsere ausgeatmete Luft enthält Kohlendioxid und trübt das Wasser (Vorsicht: Nicht ansaugen!)
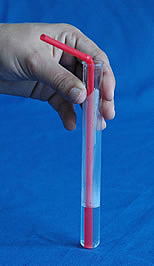


- Etwas Mineralwasser mit hohem Kohlensäureanteil in das Kalkwasser schütten: Das im Sprudel enthaltene Kohlendioxid trübt das Wasser.


- In einem Glas etwas Essig auf Backpulver schütten und das entstehende Kohlendioxid vorsichtig in das Kalkwasser „schütten“: Kohlendioxid ist schwerer als Luft, fließt aus dem Glas heraus und trübt das Kalkwasser (vgl. selbst gebauter Feuerlöscher).


So wie man Kohlendioxid mit Kalkwasser durch Trübung nachweisen kann, kann man in der vorliegende Unterrichtseinheit den Umkehrschluss anwenden. Leitet man also Kohlendioxid in kalkhaltiges Wasser, bildet sich ein weißer Niederschlag aus Kalk. Leitet man es in destilliertes Wasser, flockt kein Calciumcarbonat aus. Diesen Umkehrschluss sollen die SchülerInnen bei Versuch 3 anwenden.

